Nueva actualización para la guía ICH Q2 (R2) de Validación de procesos analíticos
Tal y como estaba previsto desde hacía meses, a finales del año 2023 se publicaron los borradores de la Guía ICH Q14 para Desarrollo de Métodos AQbD y de la Guía ICH Q2 (R2) de Validación de Procesos Analíticos. Ambas se elaboraron a lo largo del año pasado y entran en vigor en el entorno EMA en junio de 2024. Aunque en primera instancia pueda verse como una simple actualización de normativa más, esta publicación es todo un hito en el desarrollo de procesos analíticos en entorno GMP (Good Manufacturing Practices), especialmente para la guía de validación ICH Q2, pues la versión vigente había entrado en vigor en el año 1996, hace 25 años. Como es natural, en el último cuarto de siglo, la transformación de las técnicas utilizadas en los laboratorios ha sido muy evidente, por lo que la normativa estaba pidiendo a gritos una actualización. De hecho, en algunos aspectos, como en las técnicas de naturaleza multivariante como la NIR o la RAMAN, o en las orientadas a productos biológicos como PCR o ELISA, el creciente avance de las técnicas era insostenible con la guía de 1996.
LA NUEVA GUÍA ICH Q2 (R2)
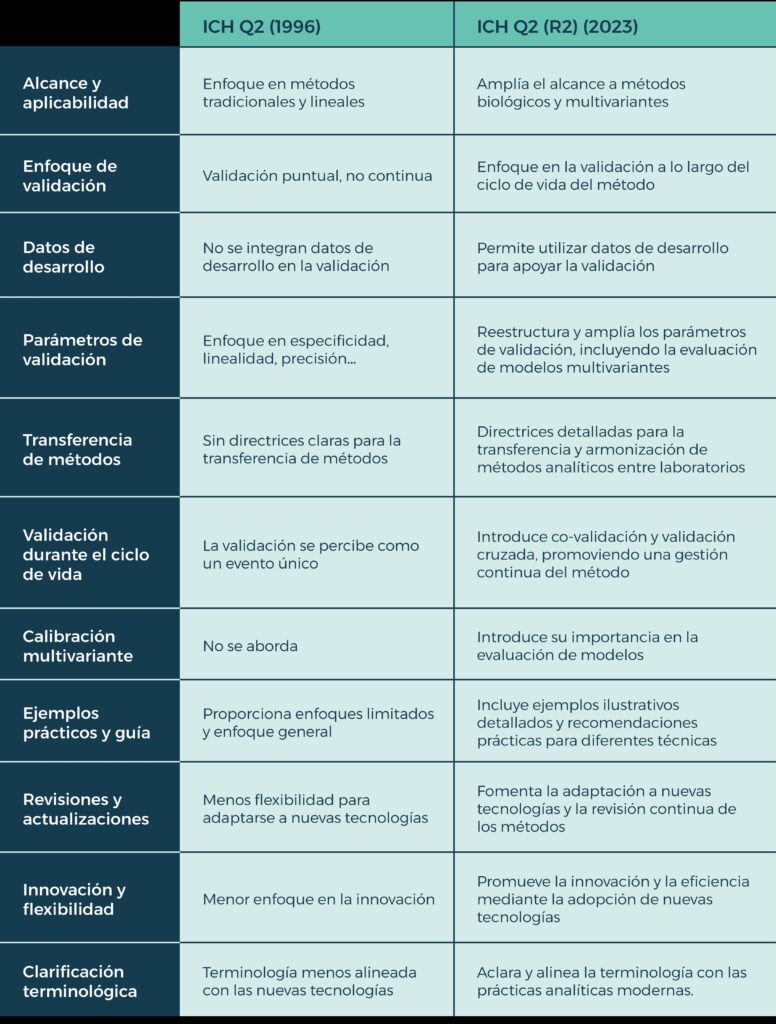
Esta nueva edición de la ICH Q2 (R2) destaca sobre sus predecesoras por el notable esfuerzo por generalizar los conceptos de validación, optando porque estos sean aplicables a todos los métodos y convirtiéndola así en una gran aliada para todos aquellos laboratorios que trabajen de forma simultánea en varios procesos. Además, al contrario que su anterior edición, presenta de forma específica recomendaciones detalladas para la evaluación de cada parámetro en diferentes técnicas, ejerciendo como un manual eficaz y de gran utilidad en la práctica. Concretamente, esta versión actual se estructura en torno a cuatro secciones principales. La primera es una introducción en la que destaca la complicidad con su guía gemela, la ICH Q14, presentando un glosario que especifica la procedencia de cada término utilizado y en cuál de las guías se recomienda buscar más información de cada uno de ellos.
Por su parte, la segunda sección se enfoca en las consideraciones a la hora poner en marcha un procedimiento analítico para el control de calidad en la fabricación de APIs y medicamentos. Durante estos párrafos, la guía reitera la necesidad de generalizar los conceptos para su aplicación a todos los métodos, y hace hincapié en los métodos multivariantes ampliamente usados como el FT-IR. Específicamente, esta última parte destaca la necesidad de establecer un método de referencia para la calibración y la obtención del modelo que convierte la señal medida en el atributo de calidad deseado.
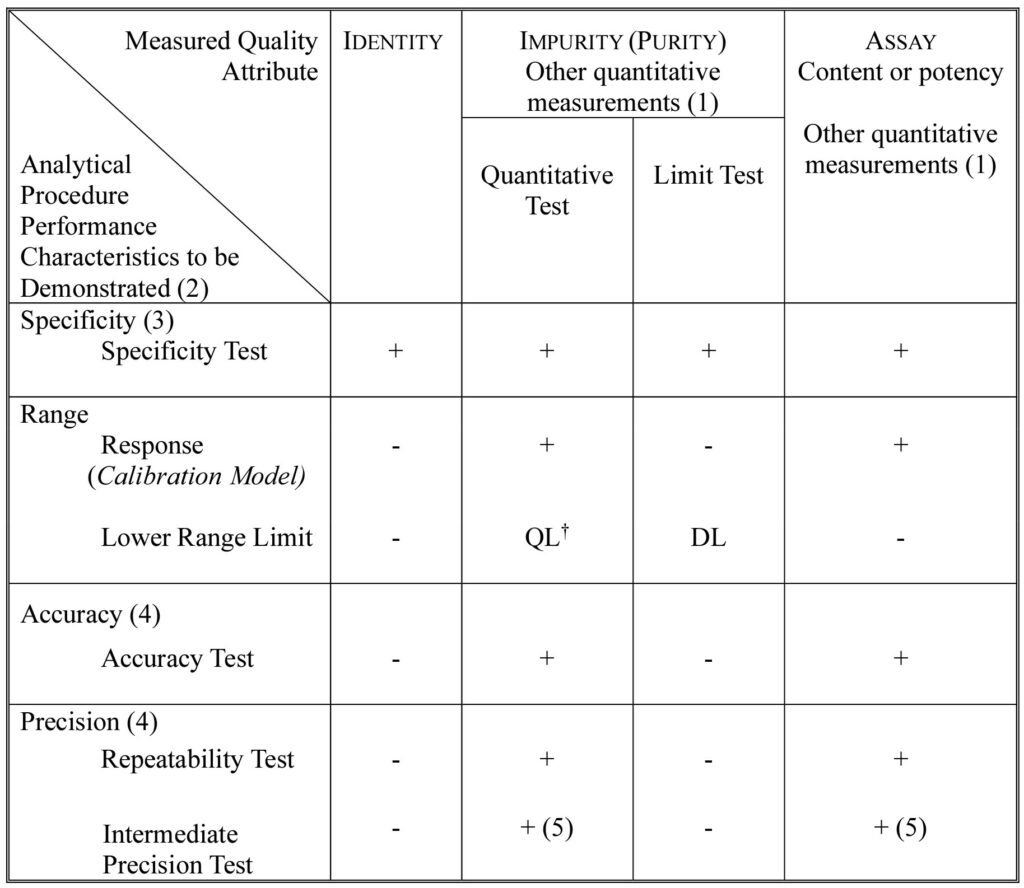
La tercera sección está íntegramente dedicada al análisis de los tests de validación, incluyendo su metodología y su evaluación. Se presta mucha atención en esta parte a cada uno de los parámetros de validación a estudiar: la especificidad y selectividad, el rango, la precisión, la exactitud y la robustez, recomendando para este último su estudio en desarrollo y no solo como parte de la propia validación.
Finalmente, se presenta el glosario mencionado al inicio y dos anexos finales, donde destaca el trato detallado que se hace de toda la información presente en la guía. Resalta aquí el Anexo 2, que recoge las recomendaciones de la metodología a aplicar para cada parámetro de validación en diferentes técnicas. Entre los ejemplos recogidos se encuentran diferentes técnicas de separación, como la HPLC, GC o CE; técnicas de análisis de impurezas elementales, como ICP-OES o ICP-MS; la disolución de HPLC como prueba de rendimiento de producto para una liberación inmediata, la 1H-NMR cuantitativa para el ensayo de un fármaco o el método LC / MS cuantitativo para el análisis de impurezas, entre otros.
EL FIN DE 25 AÑOS DE VIGENCIA
Esta actualización para la guía era, sin duda, una necesidad largamente esperada para la industria. Las secciones mencionadas proporcionan una adaptación actual a las urgencias de la industria moderna y facilitan un marco más robusto y flexible para la validación diaria y rutinaria en los laboratorios. Un ejemplo clave de esto es la ampliación del ámbito de aplicación. La versión de 1996 se centraba únicamente en técnicas analíticas convencionales y procesos lineales, como HPLC o GC, obviando así a técnicas más avanzadas que no estaban tan desarrolladas o no eran tan comúnmente utilizadas en aquel momento. Por el contrario, esta nueva versión expande su ámbito de aplicación para incluir una gama mucho más amplia de procesos analíticos, como la espectroscopía de infrarrojo cercano (NIR) o la espectrometría de alta resolución, incluyendo el abordaje para métodos no lineales y biológicos y reflejando la realidad del día a día en los laboratorios modernos.
Por otro lado, hay que resaltar que la versión vigente hasta este momento no especificaba detalladamente el uso de datos de desarrollo para la validación de métodos analíticos, ya que se centraba en la obtención de datos durante la fase de validación formal. Sin embargo, la nueva guía sí permite que los datos derivados de estudios de desarrollo se utilicen como parte de los de validación reduciendo de esta forma la necesidad de pruebas redundantes, mejorando la eficiencia del proceso de validación en sí mismo y ahorrando tiempo y recursos de forma paralela. En este mismo contexto, la nueva versión también introduce la posibilidad de reducir las pruebas de validación para procedimientos analíticos de plataforma siempre y cuando esté científicamente justificado, facilitando así la transferencia de métodos entre diversas aplicaciones.
En cuanto a la forma en la que la nueva guía aborda las definiciones y la terminología, puede apreciarse una mayor preocupación por el detalle: esta versión reemplaza el término “linealidad” por “rango de trabajo”, incluyendo la “idoneidad del modelo de calibración” y la “verificación del límite inferior del rango”, clarificando así los conceptos y facilitando una mejor comprensión de los requisitos de validación. Además, se introduce al fin el concepto de calibración multivariante, algo no abordado en la versión de 1996 debido a la limitada utilización del método en ese momento.
Pero, quizás, los dos puntos donde más se aprecia la evolución entre ambas guías son en la validación durante el ciclo de vida y en la transferencia de métodos. La guía ICH Q2 de 1996 consideraba la validación como un evento único y no incluía conceptos como la “validación cruzada” o la “co-validación”, ni proporcionaba directrices claras para la transferencia de métodos entre laboratorios, lo que podía generar inconsistencias y desafíos en la armonización de procedimientos. En oposición, la nueva ICH Q2(R2) introduce una gestión continua del ciclo de los métodos analíticos, promoviendo la armonización de enfoques y la coherencia en equipos y procedimientos, lo que facilita la transferencia de métodos como el LC/MS, asegurando su consistencia y confiabilidad independientemente del laboratorio o de la ubicación.
CICLO DE VIDA DEL LC/MS EN LA ICH Q2 (R2)
Esta nueva guía ICH Q2 (R2) es un soplo de aire fresco en AMSbiopharma, pues muchos de los servicios que ofrecemos dependen de técnicas modernas que se han desarrollado en los últimos años y cuyos procedimientos de validación pedían a gritos una regulación actualizada. Uno de estos procedimientos es la última técnica mencionada, la LC / MS, ofrecida entre nuestros servicios para la determinación cuantitativa rápida y precisa de impurezas orgánicas, una técnica cuyo ciclo de vida de validación aparece rigurosamente detallado en el Anexo 2 de la Guía ICH Q2 (R2).
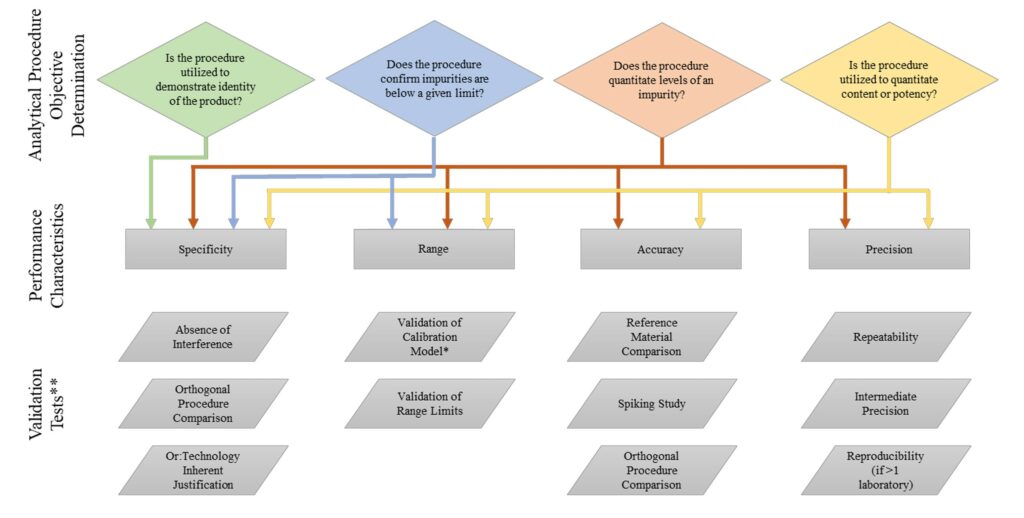
La Guía especifica que la evaluación de parámetros como la selectividad y la especificidad del método son fundamentales dado que constituyen una de las grandes ventajas de esta técnica
En cuanto a la exactitud del método LC /MS, esta debe evaluarse mediante estudios de adición de estándar sobre matriz (spiking), lo cual implica determinar la recuperación aceptable de los analitos, incorporando estándares internos que permitan manejar el efecto matriz sobre el detector MS.
Finalmente, como parte del desarrollo del procedimiento analítico de LC / MS que pauta la Guía, se realizan estudios de robustez. Esto implica variaciones deliberadas de parámetros como la velocidad del flujo de LC, el volumen de inyección, la temperatura de secado/ desolvatación del MS, entre otros, para evaluar la estabilidad de las condiciones de la prueba.
Cabe resaltar que, obviamente, es permisible iniciar otros procedimientos de validación diferentes a los pautados en la guía, siempre que se alineen con la directriz general: garantizar la fiabilidad y reproducibilidad del método analítico en el tiempo.

MODIFICACIONES PERIÓDICAS: UN FACTOR CLAVE
Así, una de las lecciones más claras de esta nueva versión es la importancia de realizar revisiones periódicas de la normativa de validación. Este tipo de actualizaciones, no solo aseguran que los métodos analíticos cumplan con los estándares más recientes de precisión y fiabilidad, sino que también fomentan la adopción de nuevas tecnologías y de mejores prácticas que pueden incrementar la calidad y la eficiencia de los análisis. Esta modernización es esencial para mantener la relevancia y la eficacia de los métodos en un momento constante cambio.
La nueva ICH Q2 (R2) trae consigo múltiples beneficios para la industria farmacéutica y la biotecnóloga, reflejando un enfoque moderno y adaptable para la validación de métodos analíticos. Estas ventajas no solo incluyen la mejora de calidad y la consistencia de los resultados analíticos, sino que también permiten una mayor flexibilidad y eficiencia para la gestión de los métodos a lo largo de su ciclo de vida. Entre ellas pueden destacarse algunas de los que ya se han ido mencionando a lo largo del artículo, como la ampliación del ámbito de aplicación, la integración de datos de desarrollo y conocimientos previos, la mejora en la metodología de validación, la clasificación y consistencia terminológica, la presencia de ejemplos ilustrativos y orientación práctica, la adecuada gestión del ciclo de vida del método, la facilitación de la transferencia de métodos entre laboratorios o el fomento de la innovación en el desarrollo de nuevos métodos.
No cabe duda: esta nueva versión es todo un avance hacia un enfoque más moderno y flexible. Proporcionando una estructura más inclusiva y adaptable, facilita la adopción de nuevas tecnologías, mejora la calidad y la consistencia de los resultados analíticos y apoya la innovación continua en la industria farmacéutica y biotecnológica.